|
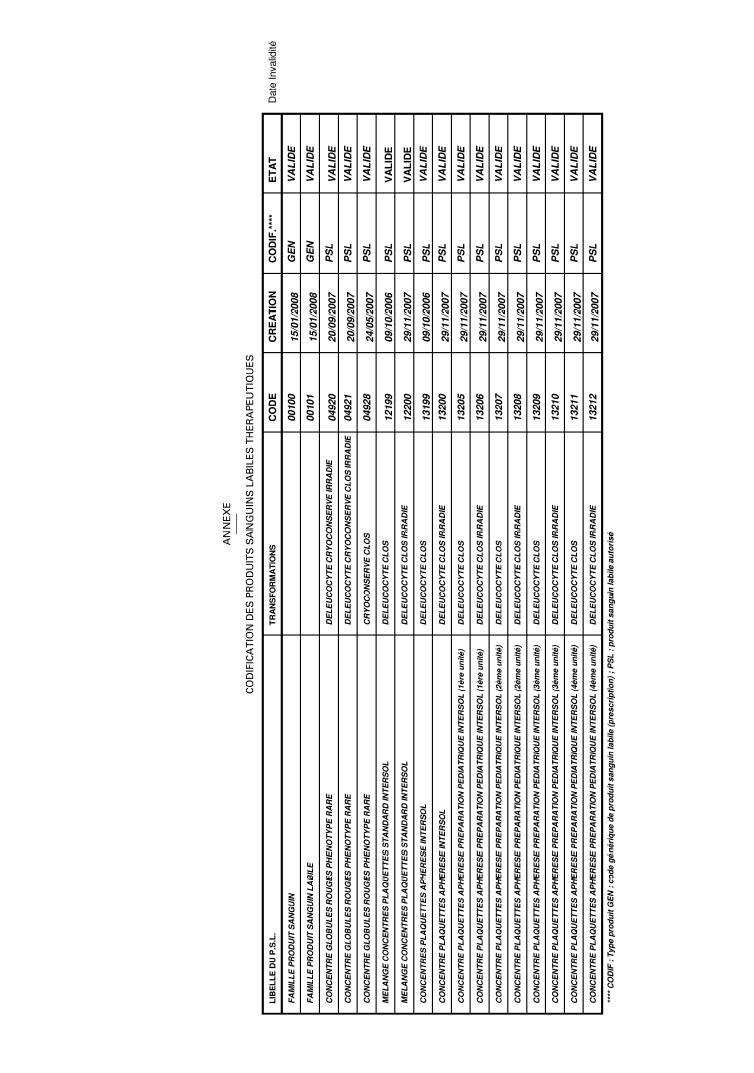
Cette décision présente en annexe la codification des produits sanguins labiles thérapeutiques
|
Le directeur générale de l’Agence française de sécurité sanitaire des produits de santé,
Vu le code de la santé publique, notamment son article R. 1221-40 ;
Vu la directive technique n° 2 bis de l’Agence française du sang du 24 novembre 1997 relative aux conditions de mise en place de l’informatisation de la traçabilité des produits sanguins labiles, prise en application de l’article R. 666-12-11 du code de la santé publique, modifiée ;
Vu les avis de l’Etablissement français du sang en dates des 21 novembre 2007 et 31 janvier 2008,
Décide :
Article 1er
A l’annexe VIII de la directive technique no 2 bis, sont ajoutés les éléments figurant en annexe à la présente décision.
Article 2
Le président de l’Etablissement français du sang est chargé de la mise en oeuvre de la présente décision ainsi que de son annexe à compter de leur publication.
Fait à Saint-Denis, le 3 mars 2008.
Source : BO Santé – Protection sociale – Solidarités no 2008/3 du 15 avril 2008, Page 123.